| 英国科学家Gregory Winter凭噬菌体展示技术获化学诺奖,以该技术研发的阿达木单抗,连续六年获全球药品销售额冠军,2016年超千亿。 |
编辑/丁林 新媒体编辑/房永珍
10月3日,2018年的诺贝尔化学奖揭晓。来自美国、英国的三位获得者受到生化进化的启发,使用相同的原理来开发解决人类化学问题的蛋白质。
其中,英国科学家Gregory Winter使用“噬菌体展示技术”进行抗体的定向进化,而第一个基于这种方法研发出的药物即大名鼎鼎的阿达木单抗(adalimumab),也即蝉联了六年全球“药王”修美乐(Humira)。

○○○
用免疫手段来治免疫病
修美乐(阿达木单抗注射液)是全球首个获批上市的全人源抗肿瘤坏死因子单克隆抗体,2002年在美国最早获批上市。作为免疫类药物,目前修美乐在全球获批的适应症多达14个,在超过96个国家或地区销售。
阿达木单抗治疗自身免疫病的原理,是通过特异性结合人体内的抗肿瘤坏死因子-α(TNF-α),阻止TNF-α与其细胞表面受体结合,从而阻断TNF-α的生物学活性,减轻炎症反应并减少免疫细胞激活,达到控制并缓解症状体征的目的。
早期的治疗用抗体往往是在鼠体内产生的,因蛋白来源的属种差异,在人体内存在的时间较短,疗效可受到影响,且有一定过敏风险。虽然可以通过与人的抗体部分组合而减少鼠来源成分的比例,但是鼠源蛋白的影响并不能完全消除。而研究者通过噬菌体展示技术,将来自健康的人类捐献者的B细胞中随机生成的抗体前体进行筛选,找出了一种由人类B细胞生成的人类抗体,但是能特异性地结合TNF-α,也就是阿达木单抗。换句话说,阿达木单抗是绕过人体自身审查消除机制而搜寻到的全人源TNF-α抗体,不仅能够有效拮抗人类的TNF-α,而且极大地减少了免疫排斥反应。
○○○
最初并不被看好
阿达木单抗最初是由巴斯夫旗下生物研究公司诺尔药业(Knoll)和英国剑桥抗体技术公司(Cambridge Antibody Technology,最初由Gregory Winter参与成立)在1993年开始进行的合作研发项目。
当时,CAT公司以噬菌体显示技术和融合蛋白库,筛选得到某一特定抗原表位的TNF抗体,经过人源化加工处理,得到第一个完全人源化抗TNF阿尔法单抗药物D2E7,经Ⅱ期临床试验证实,对类风关患者有很好的疗效。其实,当时很多公司都在研发类似的TNF抑制剂,诺尔药业投资的这一新药并未看出有任何光明的前景。尽管Ⅱ期临床效果不错,但是由于巴斯夫对于制药业并不热衷,继续研发这一新药以及未来建立营销渠道需要很大投入,巴斯夫决定回归化学主业,剥离诺尔药业。
当时在制药业沉寂很久的雅培公司,以其对阿达木单抗的积极性打动了诺尔药业,雅培最终战胜了辉瑞而成为最后的接盘者。2000年,雅培以69亿美元收购诺尔药业及其所有上市和在研产品。
当时,诺尔药业的在研产品不止阿达木单抗,但是雅培的一些高管却十分看好这款TNF抑制剂。而业内人士对雅培“人傻钱多”的做法并不看好,毕竟,阿达木单抗上市前,市场上已经有两个TNF抑制剂在售,分别是安进/辉瑞的依那西普(Enbrel,恩利)和强生的英夫利西单抗(Remicade,类克)。
这三者的作用机理类似(都是与TNF-α结合,阻碍激活TNF受体)。不过,雅培的科学家们认为阿达木单抗的优势其实很明显,作为一种同靶点后上市的跟进型药物,阿达木单抗是全人源化的单克隆抗体药物,而且是预装的皮下注射液,每周一次,使用方便。
此后,雅培花了近3年时间完成阿达木单抗的后续临床和申报,2002年底获FDA批准上市。随后——2003年9月获得欧盟药物管理局(EMA)批准;2008年4月获得日本药品医疗器械综合机构(PMDA)批准;2010年2月获得中国食品药品管理局(CFDA)批准上市。
但是,获批上市只是第一步,为了进步获得市场竞争力,雅培开始了一系列后续的临床研究——通过扩大临床试验和长期追踪,雅培已经有足够多的临床数据证明阿达木单抗临床使用安全,更自豪的数据是,类风关治疗8年病情稳定,不恶化。
○○○
既能拿诺奖又能当药王
修美乐(阿达木单抗)2012年开始,连续六年夺得全球“药王”的桂冠。2015年其年销售额达140亿美元;2016年销售额再次震撼眼球,高达160亿美元,折合人民币超过千亿。
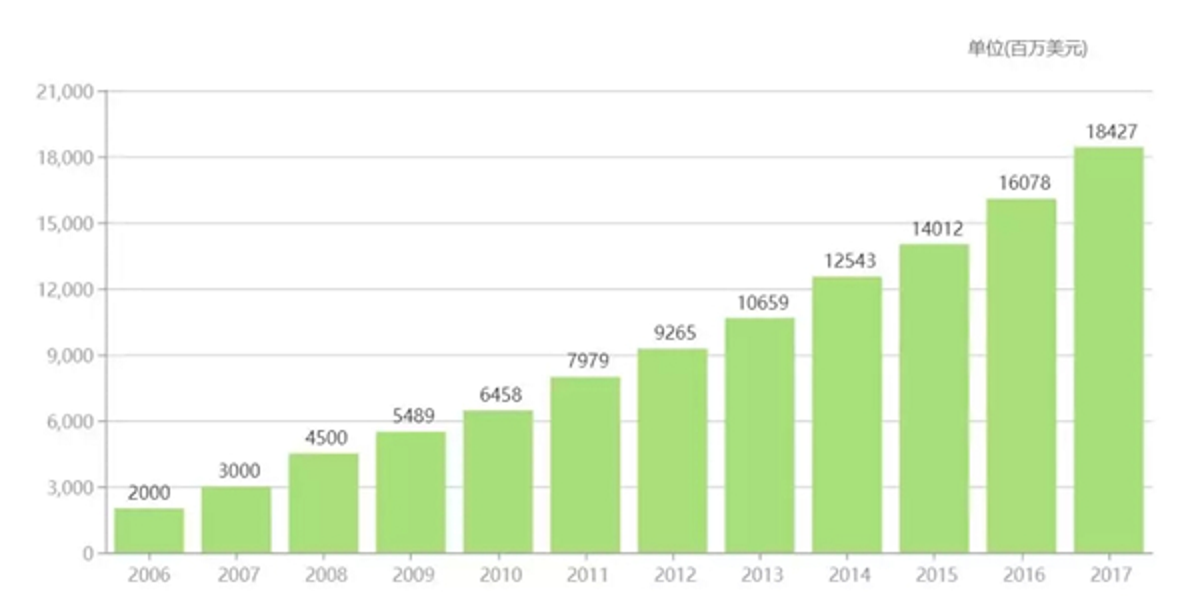
▲修美乐历年销售额。(图片来源:医药魔方)
其实,修美乐的早期推广并不顺利,原因是药物标签带有FDA黑框警告,对于复杂而难治的自身免疫疾病,痛苦的患者对药厂和医生的信任度本来就不高,由于信息不对称常常产生误解。雅培花重金投入患者沟通和教育,让患者、医生很快尽快接受修美乐。
此外,修美乐价格昂贵,医保能否全部覆盖也是关键。雅培动用各种资源,帮助患者跨越医保障碍,降低患者自付费用,帮助支付困难的患者提供补助,患者每月支付5美元,也能使用修美乐。 随着销售额快速攀升,到2013年时,年销售突破100亿。雅培为了更大力度推广修美乐,拆分出艾伯维公司,专注于生物制药研发推广,保证修美乐在后来和同类品种及生物仿制药竞争中,始终保持优势。
自2002年首次获得FDA批准上市以来,阿达木单抗已经累计创造了1161亿美元的销售收入,2017年的美国市场增速为18.5%,全球市场增速为14.6%,因此直到今天仍然以每年两位数的增幅刷新单只药品的年度销售记录。
修美乐能够接棒辉瑞公司的立普妥再次创造药物销售奇迹,成为新时代的王者,另一个关键则是因为它被认为与阿司匹林一样,能够“一药治多病”。该药在全球被批准的适应症为:
类风湿关节炎、
幼年特发性关节炎、
银屑病性关节炎、
强直性脊柱炎、
成人克罗恩氏病、
儿童克罗恩氏病、
溃疡性结肠炎、
斑块性银屑病、
化脓性汗腺炎,
以及非感染性葡萄膜炎。
在中国,阿达木单抗已经获批三个适应症:2010年获批类风湿关节炎适应症,2013年获批强直性脊柱炎适应症,2017年获批中重度斑块型银屑病适应症。
2014年,修美乐打破了由他汀类药物立普妥创造的单年最高销售记录,而立普妥连续10年全球销售第一的记录尚未打破。而在累计销售额方面,据 Informa 预测,2019年修美乐将会超过立普妥。
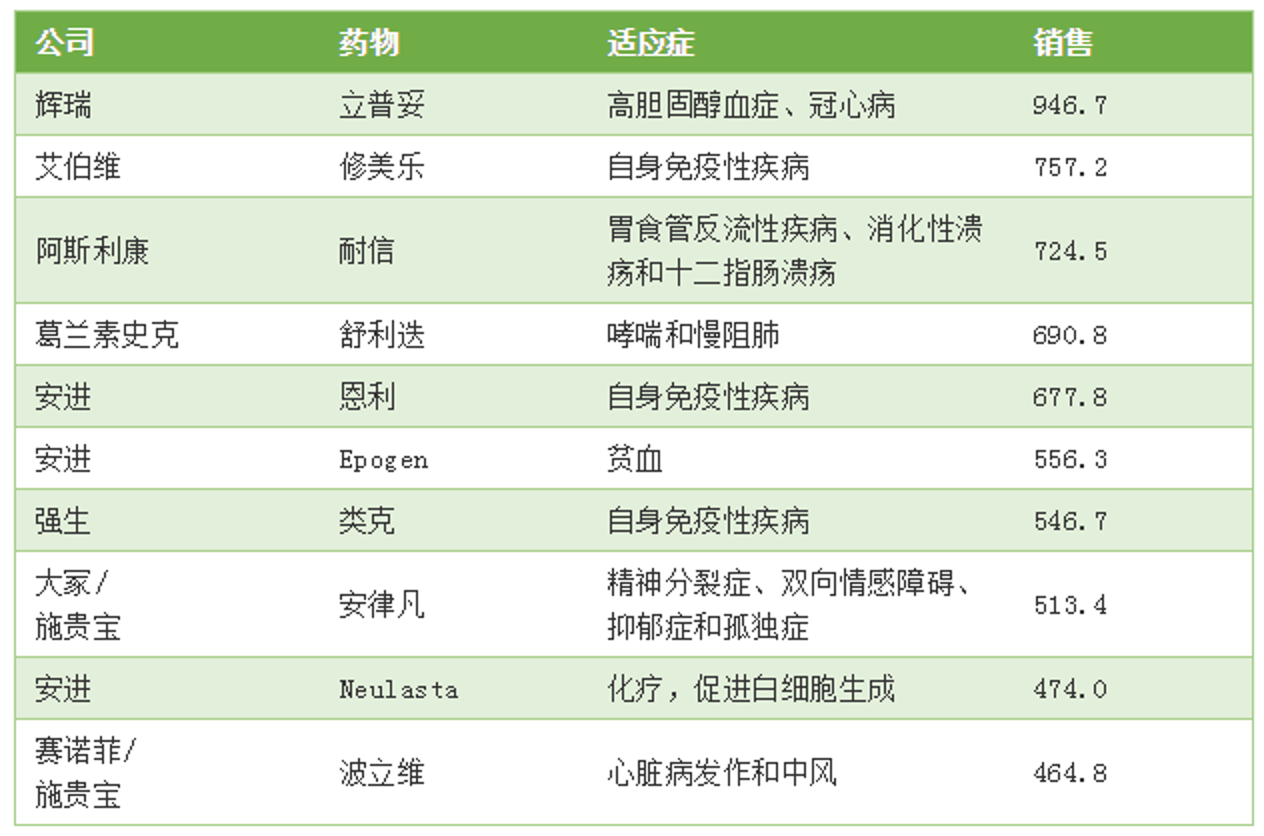
▲Fierce Pharma引用 IQVIA 数据,对从1992年到2017年美国最畅销的10大药物进行了排名。单位:亿美元。
○ ○ ○
核心专利到期,面临仿制药的挑战
截至2017年,修美乐已经连续6年占据全球药物销售榜首。不过,阿达木单抗的美国专利已于2016年12月到期,欧洲专利于2018年4月到期,中国专利于2017年2月到期。
为阻止其他生物仿制药企业在阿达木单抗专利到期之后抢占市场,艾伯维累计申请专利数十项,其到期时间将在2022至2034年之间,尤其是针对风湿性关节炎和牛皮癣等适应症注射方法申请了两个专利,并分别把专利时间延长至2022年和2023年。
由于专利悬崖临近和附加值高的原因,阿达木单抗已成为国内外公司争相仿制的品种。目前众多生物仿制药开发者早已擦拳磨掌,同时国内也掀起了一场生物类似物的开发热潮。据统计,国内阿达木单抗的仿制厂家已有10多家,其中百奥泰和信达的两项试验已进行至临床III期。
(本文由北京科技报全媒体中心编辑制作。内容综合自:药渡,医药魔方,医药代表,艾美仕)
|

出品:科普中央厨房
监制:北京科技报 | 科学加客户端
欢迎朋友圈转发
公众号、报刊等转载
请发邮件至bjkjbeditor@163.com
未经授权谢绝转载,违者必究

识别二维码,下载“科学加”客户端
|

加入北京科技报(全职/实习),bjkjbhr@163.com
投稿或推荐选题,bjkjbeditor@163.com

